les dix questions suivantes 21 à 30
|
|
|
|
La représentation graphique de la vitesse d'un mobile est donnée ci contre
- Calculez les accélérations du mobile au cours des différentes phases.
- Donnez l'équation du mouvement durant les 5 premières secondes (origine des espaces prise à t=0)
- Quelle est la position du mobile à t=5 s ?
- A quelle date le mobile change t-il de sens ?
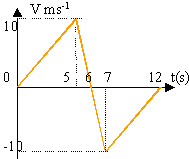
entre 0 et 5 s : 10 / 5 = 2 ms-2. La vitesse augmente, le mouvement est uniformément accéléré
entre 5 et 7 s : -20 / 2 = -10 ms-2. La vitesse diminue, le mouvement est uniformément freiné durant 1 seconde; puis la vitesse s'annule (arrêt à t=6 s). Enfin le mobile repart en sens contraire d'un mouvement uniformément accéléré.
entre 7 et 12 s : 10 / 5 = 2 ms-2. La vitesse diminue , le mouvement est uniformément freiné
la vitesse s'annule à nouveau à t= 12 s (arrêt)
durant les 5 premières secondes
v=10t et x=t².
à t= 5 s, x=25 m.
Une petite bille de masse m=200g est accrochée à un fil inextensible de longueur L=1 m. L'autre extrémité est fixée en un point O. On écarte la bille de la position d'équilibre d'un angle a0=60° avec la verticale et on la lache sans vitesse.
- Donnez l'expression de la vitesse de la bille en fonction de l'angle a.
- Calculez cette vitesse au passage à la position d'équilibre.
- Quelle doit être la vitesse initiale de la bille , écartée de a=60° avec la verticale pour que le fil atteigne la position horizontale (a=90°)
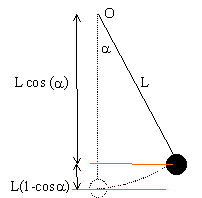
au départ, E potentielle de pesanteur : mgL(1-cos a0)=0,2*9,8*1*(1-0,5)= 0,98 J
à une date t, E potentielle de pesanteur et énergie cinétique :
0,5 m v²+ mgL(1-cos a)
L'énergie mécanique du pendule reste constante :
0,5 m v²+ mgL(1-cos a) = mgL(1-cos a0)
0,5 v²= gL(cos a -cos a0)
v²= 2gL(cos a -0,5)
au passage à la position d'équilibre a =0
v²= gL=9,8 et v=3,13 ms-1.
position finale a=90 ° et la vitesse est nulle : toute l'énergie est sous forme potentielle de pesanteur mg L = 0,2*9,8*1 = 1,96 J
au départ énergie potentielle de pesanteur (0,98 J calculée ci dessus ) et E cinétique
0,5 m v²depart + 0,98 =1,96
v départ = 3,13 ms-1.
- Qu'est ce qu'un condensateur ?
- Quelle est la relation liant la tension à ses bornes, la capacité et la charge? Préciser les unités.
- Faire le schéma du montage permettant de suivre la charge du condensateur ( condensateur de capacité C=22 mF, source idéale de tension E=5 V, résistor R=104 W, interrupteur et oscilloscope). A la date t=0, le condensateur est déchargé.
- Tracer l'allure de la courbe tension aux bornes du condensateur en fonction du temps
- Donner la valeur de la constante de temps. Quel est son interêt ?
- Quelle est la valeur finale de la charge du condensateur ?
Tension aux bornes du condensateur et charge (coulomb) sont proportionnelles . la constante de proportionnalité est la capacité en farad. QA = C UAB.
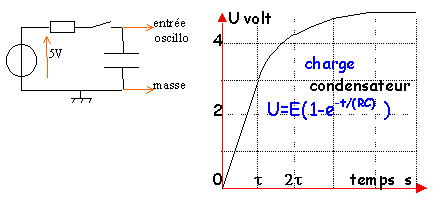
La constante de temps est égale à R C= 104*22 10-6= 0,22 s. La charge est terminée au dela d'une durée supérieure à 5 fois la constante de temps. La tension aux bornes du condensateur est égale à la tension aux bornes du générateur soit 5V.
La charge d'une armature est alors Q=22 10-6 *5 = 0,11 mC

Soit un oscillateur élastique constitué d'un ressort de raideur k=50 N m-1 et d'un solide de masse m=300g accroché à l'extrémité du ressort. La masse du ressort est négligeable devant la masse du solide. Le solide est déplacé de sa position d'équilibre d'une distance a, vers la droite et est laché sans vitesse initiale.
- Donner la définition de la raideur k d'un ressort
- Décrire le mouvement du centre d'inertie G du solide. Frottements négligeables.
- Quelles sont au cours du mouvement les énergies échangées.
- Que dire de l'énergie totale du pendule. Comment qualifie t'on un tel dispositif ?
- Etablir l'équation différentielle du mouvement de G
- Quelles sont l'expression et la valeur numérique de la période de l'oscillqteur.
- Traduire en termes énergétiques l'évolution réelle du mouvement de l'oscillateur.
Le poids et l'action du support se neutralisent. La somme des forces appliquées au solide fixé au ressort est équivalente à la tension du ressort. En appliquant la 2 ème loi de newton : -kx = mx"
![]()
valeur numérique de la
période ( m=0,3 kg) T=0,486
s.
A l'instant initial
l'énergie est sous forme potentielle élastique
: 0,5 k a²
Au passage à la position d'équilibre , toute l'énergie est sous forme cinétique 0,5 m x'²
à une autre date , l'énergie est sous forme cinétique et potentielle élastique
0,5 mx'² + 0,5 k x²= 0,5 ka²
En l'absence de frottement l'énergie reste constante : oscillateur harmonique
Dans la réalité une partie de l'énergie est perdue à cause des frottements mécaniques : l'amplitude des oscillations diminue.
- Quelles sont les espèces présentes lors de la dissolution dans l'eau du comprimé d'aspirine.
- Quelle est la réaction prépondérante ?
- Ecrire son équation bilan.
- Calculer la constante de cette réaction et conclure
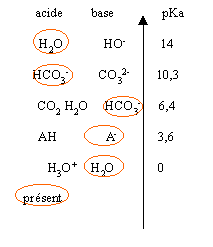
Le pH de la solution étant sans doute proche
de 7, l'acide HA est présent en faible quantité, la base conjuguée A- est majoritaire (pH>pKa). Cet acide HA est l'acide le plus fort.
La base HCO3- est la base la plus forte. CO32- n' est majoritaire qu' à pH> 10,3
![]()
calcul de la constante de cette réaction :
réaction naturelle entre base la plus forte et acide le plus fort, Kr sera plus grand que 1.
faire la différence positive des 2 pKa des couples correspondants 6,4-3,6 = 2,8
Kr= 10 2,8 = 631
la réaction est totale.
- Ecrire l'équation bilan de la dissolution du chlorure d'hydrogène dans l'eau. Quelles sont les espèces chimiques présentes en solution ?
- Quel est le pH d'une solution aqueuse telle que [H3O+]=2,5 10-4 mol L-1.
- On verse 10 mL d'acide chlorhydrique à 0,1 molL-1 dans 90 mL d'eau distilée. Quel est le pH de la solution obtenue ?
- Quel est le pH de l'eau pure à 50 °C ?
Ke=5,6 10-14 à 50°C.
les ion hydronium et chlorure sont présents en solution.
pH=-log[H3O+]= -log( 2,5 10-4)= 3,6
Le pH de la solution d'acide chlorhydrique à 0,1 mol L-1 est égal à 1. On dilue 10 fois cette solution, le pH augmente donc de 1 unité et devient pH=2
[H3O+][HO-] = 5,6 10-14.
L'eau pure contient autant d'ion hydronium que d'ion hydroxyde.
[H3O+]² =5,6 10-14.
[H3O+] =2,36 10-7.
pH=-log(2,36 10-7) = 6,62
- Donner la formule semi-développée du butan-2-ol.
- Cette molécule est-elle chirale ? Qu'appelle t'on molécule chirale , quelle est la cause de la chiralité d'une molécule ? Donner la représentation spatiale des 2 énantiomères du butan-2-ol.
- On veut fabriquer le butan-2-ol par hydratation d'un alcène noté A. A partir de quel alcène peut-on obtenir uniquement le butan-2-ol ? Donner la représentation des stéréoisomères de A. A quelle particularité de la liaison entre les deux carbones est due cette isomèrie.
- Les molécules des énantiomères du butan-2-ol peuvent exister sous différentes conformations . Qu'appelle t'on conformation d'une molécule.
- A quelle particularité de la liaison entre les 2 carbones est due l'existence des conformations. Citez le nom de deux conformations particulières que peut avoir une molécule de butan-2-ol.
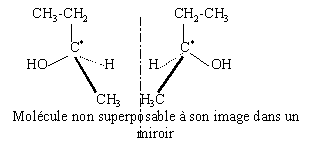
La cause de la chiralité est la présence d'un carbone asymétrique.
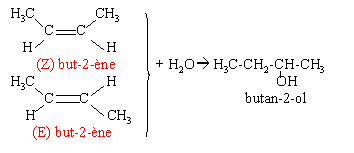
pas de rotation possible autour d'une liaison double carbone carbone d'où l'isomèrie Z E.
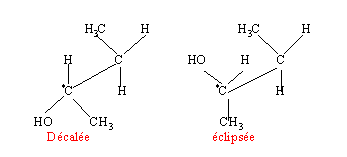
On passe d'un conformère à un autre par simple rotation autour de la liaison simple carbone carbone.
- Quel est le rôle d'un catalyseur ? Qu'est-ce qu'une catalyse homogène ? Qu'est-ce qu'une catalyse hétérogène ?
- Le peroxyde d'hydrogène se décompose
naturellement en dioxygène et en eau. Cette
réaction est lente. On étudie la
réaction de décomposition de 6
10-4 mol de peroxyde d'hydrogène
placée à l'instant t=0 dans 100 mL d'eau.
Les ions Fe3+ catalysent la réaction.
On dose toutes les 5 minutes la quantité de
peroxyde d'hydrogène restant
Ecrire l'équation bilant (min) 0 5 10 15 20 n H2O2 restant 0,0006 0,00046 0,00037 0,00029 0,00023 n O2 formé 0 0,00007 0,000115 0,000155 0,000185 - Indiquer comment la quantité de O2 a été calculée.
- La vitesse moyenne de formation du dioxygène entre les dates t=5 min et t=10 min a pour valeur 9, 10-6 mol min-1. Comment a t-on fait ce calcul ?
catalyse homogène : catalyseur et réactifs sont dans la même phase (en solution )
catalyse hétèrogène : catalyseur solide (métal) et réactifs dans une solution
H2O2 --> 0,5 O2 + H2O
Qté de matière O2 = 0,5 fois Qté de matière H2O2 ayant réagi
Qté de matière H2O2 ayant réagi = Qté initiale - Qté à la date t
vitesse formation O2
=( Qté O2 à t=10 min - Qté O2 à t=5 min ) / durée
(0,000115 - 0,00007) / 5 = 9 10-6 mol min-1.
- Définir réactif électrophile, nucléophile, les mots hydrophobe, lipophile
- Ecrire l'équation bilan entre la solution d'éthanoate d'éthyle et la solution d'hydroxyde de sodium. quel réactif possède un site nucléophile, électrophile. Nommer les produits obtenus.
- Quelle est la différence entre cette réaction et la réaction d'hydrolyse de cet ester.
- Quel type d'ester utilise t-on pour fabriquer un savon ? Ecrire sa formule générale
- Ecrire l'équation bilan de la réaction permettant de fabriquer un savon.
- Quelle est la formule semi- développée du savon ? Où est dans cette formule la partie hydrophile, et la partie lipophile ?
réactif nucléophile : possède un site riche en électrons
hydrophile : groupe d'atomes s'entourant facilement de molécules polaires comme l'eau
hydrophobe : groupe ne s'entourant pas de molécules d'eau
lipophile : groupe ayant une affinité pour les chaines carbonées présentes dans les graisses.

La saponification d'un ester par une base forte est lente mais totale alors que l'hydrolyse d'un ester est lente et limitée.
ester issu d'un acide gras, dont la chaine carbonée non ramifiée possède plus de 10 carbones
La saponification d'un tel ester conduit à un savon : mélange d'ion carboxylate de sodium ou de potassium RCOO- K+.
La partie lipophile est la longue chaine carbonée
La partie hydrophile est le groupe carboxylique.
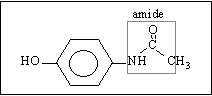
- Quelle fonction organique principale possède cette molécule ?
- Donner les formules semi développées de l'acide carboxylique et de l'amine permettant la synthèse de cette molécule.
- Dans la réalité on préfère utiliser l'anhydride d'acide plutôt que l'acide carboxylique . Pourquoi ?
- Donner la formule et le nom de l'anhydride d'acide.
- Ecrire l'équation bilan de la réaction.
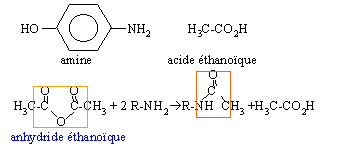
Les anhydrides d'acides sont beaucoup plus réactives que les acides carboxyliques.