|
|
|
|
un détartrant, l'acide sulfamique : un acide fort
- Calculer le volume molaire d'un gaz parfait à 20°C et sous P=1 bar=105 pascals.
- Un détartrant contient essentiellement de l'acide sulfamique(H2)N-(SO3)H . On considère que c'est le seul acide contenu dans le détartrant, il se comporte comme un acide fort. On prépare une solution de soude en dissolvant un peu plus d'un gramme d'hydroxyde de sodium dans 5OO mL d'eau : on obtient une solution S1 . On doit calculer la concentration de S1 en dosant 2O ml de S1 avec de l'acide chlorhydrique à 0,05molL-1 . L'équivalence est obtenue pour 22,5 mL d, 'acide chlorhydrique . Quelle est la concentration de S1.
- La dissolution de 500 mg de détartant dans 100ml d'eau conduit à une solution S2. On dose 20ml de S2 avec la solution S1. L'équivalence est obtenue lorsqu'on a versé 17,2ml de S1. Calculer la concentration de S2.
- Calculer le pourcentage en masse d'acide sulfamique dans le détartrant étudié. S=32 ; O=16 : H=1 ; N=14 gmol-1.
PV=nR T avec R=8,31 JK-1 mol-1.
volume d'une mole =
8,31*(273+20)/105=
24,34 L
mol-1.
concentration
de la soude
A l'équivalence du dosage soude acide chlorhydrique
CAVA = CBVB concentrations en molL-1 et volume en L
CB =0,05*0,0225/0,02=
0,056
molL-1
concentration
de l'acide sulfamique
A l'équivalence du dosage soude acide sulfamique
CAVA = CBVB concentrations en molL-1 et volume en L
CB =0,056*0,0172/0,02=
0,048
molL-1
pourcentage
massique de l'acide sulfamique
masse molaire de cet acide : 2+14+32+3*16+1 = 97 g mol-1.
Qté de matière dans 100 mL de S2 (mol): volume (L) * concentration (mol L-1)
0,1*0,048= 0,0048 mol
masse (g) d'acide dans 500 mg ou 0,5 g = Qté matière (mol)* masse molaire (g mol-1)
0,0048*97= 0,465 g
% massique = masse d'acide (g)*100 / masse détartrant (g)
0,465 / 0,5 = 93%
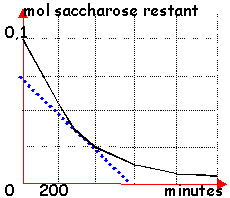
cinétique : hydrolyse du saccharose
- On dissout 34,2g de sacharose dans de l'eau afin
d'obtenir 100 mL de solution, et on déclenche le
chronomètre. Quel que soit l' instant choisi comme
origine des temps, on constate que, si N est la
quantité de saccharose présent à cet
instant, il faut attendre 200 min pour que la
quantité de saccharose restant en soluton soit
égale à N/2 (dans les conditions de
l'expérience). La réaction de dissolution
du saccharose dans l'eau est:
C12H22O11 + H2O donne C6H12O6 + C6H12O6 glucose et fructose
- Tracer la courbe donnant la concentration du glucose formé en fonction du temps de t=0 à t=1200 min.
- Et déduire la vitesse de disparition du saccharose à la date t=300 min
..
masse molaire =342g mol-1.
masse (g) / masse
molaire
(gmol-1) = 34,2/342
= 0,1 mol dans 0,1 L
0,0625 0,031 0,075 / 600=
1,25
10-4 mol
minute-1.
pH - concentration - dilution -acide fort
- Rappeler la définition du pH d'une solution aqueuse.
- La concentration en ions H3O+ d'une solution A est [ H3O+ ]=2,0*10-3 mol.L-1. Calculer son pH.
- Une solution aqueuse B a un pH égal à 3,5. Calculer la concentration en ions H3O+ de la solution B.
- Calculer le nombre de moles d'ions H3O+ contenues dans un volume V=20mL de cette solution B.
- On prépare une solution C en mélangeant un volume V=20mL de la solution B avec un volume V'=80mL d'eau pure. Calculer la concentration du mélange en négligeant les ions H3O+ provenant de la dissociation de l'eau. En déduire le pH de la solution C.
..
l'échelle usuelle des pH va de 1 à 14 ; en solution concentrée il n'y a plus de relation simple entre pH et concentration .
pH=-log(2,0*10-3 ) = 2,69
[H3O+] =10-pH=10-3,5= 3,16 10-4 mol L-1.
Qté de matière (mol) d'ion hydronium = volume (litre) * concentration (mol L-1)
0,02*3,16
10-4 = 6,3
10-6 mol
dilution
de la solution B
Le volume final est 5 fois plus grand que le volume initial; la concentration de la solution C est 5 fois plus petit que celui de la solution B soit 6,32 10-5 molL-1.
le pH augmente de log(5)= 0,7 et devient 3,5+0,7 =4,2
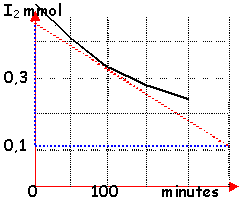
cinétique : H2+I2 donnent 2 HI
On porte à 350°C quatre ballons de 1L:A,B,C et Drenfermant chacun 0,50 mmol de H2. Les ballons sont maintenus à cette température durant des durées différentes,puis ils sont brutalement refroidis. Le diiode restant dans chaque ballon est d'abord dissous dans une solution d'iodure de potassium(qui prend une couleur jaune),puis il est dosé par une solution de thiosulfate de sodium de formule Na2S2O3 et de concentration molaire C=0,050mol.L-1.
- La fin du dosage est indiquée par la
décoloration de la solution de diiode.Soit
Véq le volume de la solution de thiosulfate de
sodium nécessaire pour obtenir la
décoloration.
On donne les couples rédox suivant:I2/I- 0,62V; S4O62-/S2O32- 0,09V.
- Expliquer le principe général de la manipulation.
- Expliquer le principe du dosage de diiode en solution et écrire l'équation de la réaction correspondante.
- Complèter le tableau suivant regroupant les
résultats expérimentaux
obtenus:
ballon A B C D t (min) 50 100 150 200 Véq (mL) 16,6 13,7 11,4 9,4 nS2O32- (mmol) n(I2) restant (mmol) - Tracer la courbe représentant la quantité de diiode restant dans le milieu réactionnel en fonction du temps. En déduire la vitesse instantannée de disparition du diiode à t=100 min. En déduire la vitesse instantannée de formation de l'iodure d'hydrogène à la même date.
.
Le diiode constitue l'oxydant fort et l'ion thiosulfate le réducteur fort
I2 +
2
S2O32-
donnent
2
I- + S4O62-
0,83 0,685 0,57 0,47 ayant
réagi 0,415 0,34 0,285 0,235 0,34 / 250= 1,3
10-3 mmol
minute-1. la vitese de formation de
HI est 2 fois plus grande
(voir coef.
équation)
acide dans la piscine
Une piscine de longueur L=25 m, de largeur l=6 m est remplie d'eau sur une hauteur h=2,5 m .On mesure le pH de l'eau pH = 5,5. On y verse 250 mL d'acide chlorhydrique de concentration 12 mol L-1. Calculer le pH final en considérant que les ions hydronium apportés par l'acide s'ajoutent à ceux apportés par l'eau.
..
l'eau:
volume de la piscine (L) * 10 -pH = 25*6*2,5*1000*10-5,5= 1,18 mol
l'acide:
volume acide (L)* concentration =
0,25*12=
3 mol
pH final de
l'eau de la piscine
4,18 mol d'ion hydronium dans 25*6*2,5*1000 L
[H3O+] = 4,18 / 375000= 1,11 10-5 mol L-1.
pH=-log(1,11 10-5)= 4,95
dosage des ions chlorures (Mohr)
Un sachet de soupe a 78 g de matière déshydratée dont 10,8% de sel(NaCl). On dissout le contenu du sachet dans 1 L d'eau. Un prélèvement de 10 mL de solution est dosé par la méthode de Mohr. Il faut 13 mL d'une solution de nitrate d'argent à 0,103 molL-1 pour atteindre l'équivalence.
- Quelle est la concentration de la solution en ions Cl- ?
- Quelle est la masse de sel dans le sachet ? Est elle en accord avec l'indication ?
Na=23 ; Cl=35,5 g mol-1.
.
Qté de matière (mol) NaCl : masse (g) / masse molaire ( g mol-1)
8,42/(23+35,5)=
0,144 mol NaCl
dans 1 L (d'après
étiquette)
dosage
: Cl-
+ Ag+ donne
AgCl
solide blanc
à l'équivalence : Qté de matière NaCl (mol) = Qté de matière ion Ag+ (mol)
[NaCl]*0,01= 0,103*0,013
[NaCl] = 0,134 mol L-1 (écart 8%)
décomposition de l'eau oxygénée cinétique
On étudie la décomposition de l'eau oxygénée: 2 H2O2 donne 2 H2O + O2
à t=0, on a dans la solution 0,06 mol de H2O2 et le volume est 1 L. On mesure le volume V de dioxygène formé.
- Exprimer la quantité de matière de dioxygène formé à la date t en fonction de V et du volume molaire Vm.
- En déduire à la même date la quantité en moles de H2O2 disparue puis la concentration de H2O2 restante notée c.
.
V/Vm
La quantité de matière (mol) d'eau oxygénée disparue :
est deux fois plus grande que la quantité de O2 formé. (voir coef de l'équation bilan) :
2 V/Vm
est égale à la quantité initiale moins ce qui reste : 0,06-c
2 V/Vm = 0,06-c donc c=0,06-2 V/Vm
réaction prépondérante : pH d'un mélange
- Considérons un litre de solution obtenue en dissolvant dans l'eau 0,2 mol d'acide éthanoïque, 0,15 mol d'hydroxyde de sodium, 0,02 mol de cyanure de potassium (KCN solide ionique totalement dissocié en solution aqueuse) et 0,16 mol d'éthanoate de sodium. CH3COOH / CH3CO2- pKa = 4,8 ; HCN /CN- pKa = 9,3
- Placer sur une échelle des pKa les couples qui interviennent dans la solution.
- Quelle est la réaction prépondérante.
- Ecrire l'équation-bilan.
- Calculer sa constante d'équilibre ou constante de réaction Kr. Conclure.
- Quelles sont les concentrations des espèces présentes en solution.
- Déterminer la nouvelle réaction prépondérante.
- Ecrire l'équation-bilan.
- Calculer sa constante d'équilibre ou constante de réaction Kr. Conclure.
- Quelles sont les concentrations des espèces présentes en solution.
- En déduire le pH de la solution.
..
|
HO- + H3CCO2H donnent H2O + H3CCO2- Kr=10-4,8 / 10-14 = 109,2 réaction totale il reste 0,05 mol ac éthanoique, la soude étant en défaut il se forme 0,15 mol ion éthanoate |
HCN / CN- ........9,3 ac éthanoique/ ion éthanoate ...........4,8 |
|
CN- + H3CCO2H donnent HCN + H3CCO2- Kr=10-4,8 / 10-9,3 = 104,5 réaction totale il reste 0,03 mol ac éthanoique, l'ion CN- étant en défaut il se forme 0,03 mol ion éthanoate et O,03 mol HCN |
ac éthanoique/ ion éthanoate ...........4,8 |
3 espèces présentes après réaction : CH3COOH ; CH3CO2- ; HCN
* l'acide le plus fort est CH3COOH (0,03 mol)
* la base la plus forte est CH3CO2- (0,34 mol)
pH=pKa+ log[CH3CO2-] / [CH3COOH]=4,8+log(0,34/0,03)= 5,85
acide faible et base faible
- Un acide faible est-il un acide dilué ?
- Le pH d'une solution aqueuse d'acide benzoïque de concentration 10-3 mol.L-1 est 3,7. L'acide benzoïque est-il un acide fort ou un acide faible ?
- Le pH d'une solution aqueuse de méthylamine CH3 -NH2 de concentration 10-2 mol.L-1 est de 11,3. La méthylamine est-elle un acide fort, un acide faible, une base forte ou une base faible ?
.
Dans le cas d'un acide fort la réaction avec l'eau est totale et le pH de la solution vérifie la relation pH = - lg c. Ici la concentration est de 10-3 la relation n'est pas vérifiée puisque pH =3,7 . L'acide benzoïque est bien un acide faible.
. La méthylamine est bien une base car son pH est supérieur à 7 mais c'est une base faible : dans le cas d'une base forte la réaction avec l'eau est totale et le pH d'une solution de monobase forte vérifie la relation pH = 14 + lg c . Or ici pour 10-2 mol.L-1 le pH est égal à 11,3 au lieu de 12 donc la méthylamine est une base faible .
monoéthylamine
On prépare une solution aqueuse en dissolvant 0,2 mole de monométhylamine par litre de solution ; la mesure du pH donne la valeur 12 à 25°C.
- en déduire les espèces chimiques présentes dans la solution.
- déterminer leurs molarités.
- comparer les populations en présence.
- Montrer que la monométhylamine est une base faible; quel est l'acide conjugué ?
- Déterminer le pK de ce couple.
- Sachant que le pK du couple NH4+/NH3 est 9,2 quel est, de ces 2 couples, celui qui possède la base la plus forte ?
..
|
|
|
|
|
|
|
|
|
|
[H3C-CH2-NH3+] peu différent de [OH-] =10-2 mol L-1 |
|
|
[H3C-CH2-NH2 ] =0,2-0,01=0,19 mol L-1 la réaction de la monoéthylamine avec l'eau est partielle : la monoéthylamine est une base faible. |
|
|
pKa=12-log(0,19/0,01)=10,7 le couple qui possède la base la plus forte, est celui qui a le plus grand pKa |
|