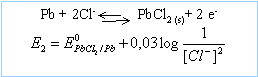|
|
||||||
|
||||||
|
pile Daniell |
Le potentiel standart de la pile Daniell varie avec la température (T en °Celcius): E0=1,1 -0,64 10-3 T+ 0,72 10-5 T2. Calculer DG0, DH0, DS0 de la réaction : Cu2+ + Zn --> Cu + Zn2+(1,1 -0,64 10-3 T + 0,72 10-5 T2) corrigé |
|||||
|
DG0 = -2*96500*(1,1 -0,64 10-3 *25 + 0,72 10-5 *252) DG0 = -210,08 kJ mol-1. DS0 = 2*96500 (-0,64 10-3 +2*0,72 10-5 T) DS0 = 2*96500 (-0,64 10-3 -2*0,72 10-5 *25) DS0 = -54,04 J mol-1. DH0 = -210 080 + 298*(-54,04) = - 226,18 kJ mol-1.
|
||||||
|
étude thermodynamique de pile |
La fem de la pile suivante est 0,49 V à 298 K. La fem varie avec la température avec un cefficient de température valant - 1,84 V K-1. Ag(solide) / AgCl(solide) /HCl /PbCl2 (solide)/ Pb(solide).
entropie molaire standart (J mol-1 K-1) : Pb solide : 64,82 ; Ag solide : 42,66 ; AgCl solide : 96,19 . corrigé |
|||||
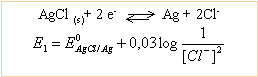
E = E1-E2 = E0AgCl/Ag - E0PbCl2/Pb indépendante de la concentration de l'acide.
2AgCl + Pb --> 2Ag + PbCl2 réaction entre solides DG0=- 2*96500*0,49 = -94,57 kJ mol-1.
Le coefficient de température est relié à la variation d'entropie DS0= nF dE/dT=2*96 500*1,84 10-4 = 35,5 J mol-1 K-1. DS0= 2 S0 Ag(s) + S0 PbCl2 (s) - S0 Pb(s) -2 S0 AgCl (s) S0 PbCl2 (s) = 136,4 J mol-1 K-1 |
||||||
|