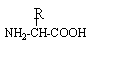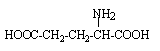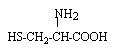|
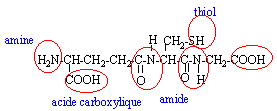
les acides aminés .
|
||||||
|
||||||
|
|
alanine et acide nitreux : 153 g d'alanine réagissent avec 100 g d'acide nitreux HNO2.
masse atomique molaire en g/mol : C=12 ;N=14; O=16 ; H=1. à la Saint "glygly" : On réalise l'expérience de condensation de la glycine dans les trois cas suivants : - 130g sont condensés en dipeptide. - 140 g sont condensés en tripeptide. 150 g sont condensés en tétrapeptide.
le gluthation : C' est un tripeptide dont la formule est la suivante : 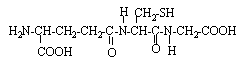
|
|||||
|
alanine CH3 - CH(NH2) -COOH + HNO2 donne CH3-CH(OH)-COOH + N2 + H2O mase molaire alanine : 89 g/mol 153 / 89 = 1,72 mol alanine acide nitreux : 47 g/mol 100/47 = 2,13 mol donc excès (1,72 mol alanine nécessite 1,72 mol d'acide nitreux) N2 : 1,72 mol volume diazote : 1,72 fois le volume molaire des gaz 22,4 donne 38,5 L. exercice 2 : glycine 2 NH2CH2-COOH donne NH2-CH2-CO-NH-CH2-COOH +H2O masse molaire glycine : 75 g/mol 130 /75 = 1,73 mol donc 0,87 mol dipeptide masse dipeptide 0,87* masse molaire dipeptide (132g/mol ) = 114,4g . 3 NH2CH2-COOH donne NH2-CH2-CO-NH-CH2-CO-NH-CH2-COOH + 2H2O 140 /75 =1,86 mol donc 1,86 / 3 = 0,62 mol tripeptide masse molaire tripeptide 189 g/mol 189*0,62 = 117,2 g. 4 NH2CH2-COOH donne NH2-CH2-CO-NH-CH2-CO-NH-CH2-CO-NH-CH2-COOH + 3H2O 150 /75 =2 mol donc 2 / 4 = 0,5mol tripeptide masse molaire tripeptide 246 g/mol 246*0,5 = 123 g. exercice 3 :
deux fonctions amides : donc deux liaisons peptidiques hydrolyse : coupure des liaisons peptidiques on retrouve les acides a aminés : le groupe amine NH2 est en position a de la fonction acide carboxylique
l'hydrolyse conduit à : acide glutamique : cystéine : glycine :
|
||||||
|