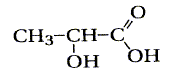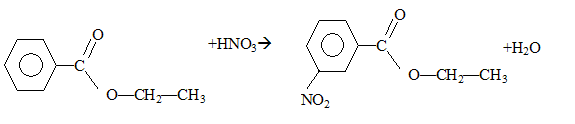|
polarimétrie
; radioactivité et datation ; chimie organique : solution tampon
d'après
bts biochimie 2005
|
|
|
|
|
Polarimétrie
( 13 points)
L'acide lactiquede formule brute C3H6O
est un composé organique de formule semi-développée 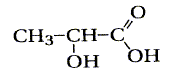
L'acide lactique se forme en très petite quantité dans
les muscles au cours d'efforts physiques. La libération de grande
quantité d'acide lactique peut provoquer des crampes.
- Définir une substance optiquement active.
- Décrire une expérience simple permettant de mettre en
évidence l'activité optique d'une substance. Faire un shéma légendé.
- Enoncer la loi de Biot et définir chaque terme
employé avec son unité SI. A l'aide d'un tube polarimétrique de
longueur l= 30 cm, on mesure les angles a
de rotation que produisent des solutions étalon d'acide L-lactique sur
le plan de polarisation de la lumière. On obtient le tableau de mesures
suivantes ( à 25°C pour la raie D du sodium)
|
concentration en kg m-3
|
0
|
40,0
|
80,0
|
120
|
160
|
200
|
|
a (
°)
|
0
|
2,29
|
4,56
|
6,82
|
9,15
|
11,3
|
- Déterminer le pouvoir rotatoire spécifique de l'acide
L-lactique [aL]
On dispose d'une solution de lait que l'on a laissé à l'air libre. Les
bactéries se sont développées et secrètent une enzyme capable
d'hydrolyser le lactose du lait. On a filtere cette solution afin
d'obtenir une solution limpide et transparente.
- On mesure le
pouvoir rotatoire de cette solution A aA= 5,17°, déterminer
en kg m-3, puis en mol L-1,
la concentration de la solution A. On supposera que l'acide lactique
est présent uniquement sous sa forme eéntiomère L dans la solution.
- On effectue un
mélange d'une solution d'acide d'acide L-lactique et d'une solution
d'acide D-lactique aux mêmes concentrations. Comment nomme-t-on ce type
de mélange ? Quel serait l'angle de déviation du plan de polarisation
de la lumière ? Justifier.
Masse atomique molaire en g/mol : C : 12,0 ; H : 1,0 ; O : 16,0
corrigé
substance
optiquement active : solide,
liquide ou substance dissoute en solution provoquant une rotation du
plan de polarisation de la lumière polarisée traversant la substance.
La polarimétrie,
technique de chimie analytique permet de doser la teneur d'une solution
en substances optiquement actives.
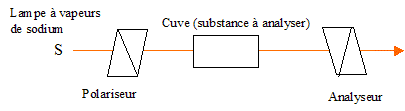
L'axe de l'analyseur
est perpendiculaire au polariseur. L'intensité de la lumière transmise
par le dispositif est nulle.
En remplissant la
cuve d'eau, composé optiquement inactif, l'intensité de la lumière
transmise est nulle.
En remplissant la
cuve d'une solution aqueuse de saccharose, composé optiquement actif,
l'intensité de la lumière transmise n'est pas nulle : on retrouve une
intensité nulle, en tournant l'analyseur d'un angle a.
Loi de Biot traduit
la proportionnalité entre le pouvoir rotatoire d'un milieuet les
concentrations en produits optiquement actifs (dextrogyres ou
lévogyres) :
a = [a]l, T.C.l
a (°) angle de rotation du plan de vibration
des ondes lumineuses ; [a]
: pouvoir rotatoire spécifique ( ° m2 kg-1
); C: concentration ( kg m-3 ) ; l : longueur (m) de cuve
|
concentration C : kg m-3
|
0
|
40,0
|
80,0
|
120
|
160
|
200
|
|
a (
°)
|
0
|
2,29
|
4,56
|
6,82
|
9,15
|
11,3
|
|
[a] = a/(C
l) = a/(0,3C)
|
xxxxxx
|
0,191
|
0,190
|
0,189
|
0,191
|
0,188
|
[a] =
0,190 ° m2 kg-1.
a = [a]l, T.C.l donne C= a /( [a]l, T.l)=5,17
/(0,190*0,3)= 90,7 kg m-3= 90,7 g/L
Masse molaire acide
lactique C3H6O : M= 12*3 + 6+16 = 58 g/mol
C= 90,7 / 58 = 1,56 mol/L.
solution d'acide
d'acide L-lactique et d'une solution d'acide D-lactique aux mêmes
concentrations : mélange racémique.
angle de
déviation du plan de polarisation de la lumière :
a = [aL]l, T.C.l + [aD]l, T.C.l = ( [aL]l, T+ [aD]l, T) C l
Les pouvoirs
rotatoires spécifiques de deux énantiomères sont égaux en valeur
absolue mais de signes opposés : [aL]l, T+ [aD]l, T=0 d'où a=0
|
|
Radioactivité et
datation géologique (12 points).
- Il existe trois types de désintégrations radioactives
: a, b-, b+. Quelle
est la nature des particules émises dans chacune de ces désintégrations
?
- Le potassium 4019K
est radioactif et se désintègre en donnant de l'argon 4018Ar
. Ecrire l'équation de la désintégration en rapellant les règles
utilisées.
- Définir la demi -vie notée t½.
- La demi vie du potassium 4019K
est 1,3 109 ans. En déduire la valeur de sa
constante radioactive l.
Dans certaines roches volcaniques on décèle la présence de potasium 4019K
radioactif. Lors d'une éruption volcanique, tout l'argon sévapore sous
l'effet des conditions de température et de pression / on dit que la
lave se dégaze. A cette date, considérée comme instant initial t=0, la
lave volcanique se solidifie et ne contient pas d'argon. Plus tard, à
l'instant t, on effectue un prélevement de roche sur le site volcanique
ancien. Un spectrographe détermine la composition massique de ce
prélevement , qui contient, entre autre : mK=
1,57 mg de 4019K et mAr=
82,0 mg de 4018Ar
- Déterminer le nombre d'atomes de potassium 40 ( NK)
et le nombre d'atomes d'argon 40 ( NAr) à la
date t.
- On note N0 le nombre d'atomes
de potassium 40 contenus à la date t=0 dans la roche prélevée à la date
t. Justifier la realtion N0= NK+NAr.
- Exprimer le nombre d'atome NK(t)
de potassium 40 en fonction de t, N0, l.
- Déterminer la date approximative de l'éruption.
M(K) voisin M(Ar) = 40,0 g/mol ; NA= 6,02 1023
mol-1.
corrigé
a : noyau d'hélium ; b-:
électrons ; b+
: positons.
4019K = 4018Ar
+ AZX
conservation du nombre de nucléons : 40 = 40 +A d'où A=0
conservation de la charge : 19=18+Z d'où Z= 1 ; on
identifie X à un positon.
La demi-vie est la durée au bout de laquelle la moitié
des noyaux initiaux se sont désintégrés.
lt½=ln2 soit l = ln2 / t½
= ln2 / 1,3 109 = 5,33
10-10 an-1.
nombre d'atomes de potassium 40 ( NK)
et le nombre d'atomes d'argon 40 ( NAr) à la
date t.:
NK= mK
/M(K) * NA=1,57 10-3 / 40
*6,02 1023 = 2,36 1019
atomes
NAr= mAr
/M(Ar) * NA=82 10-6 / 40
*6,02 1023 = 1,23 1018
atomes
à t=0 : N0= NK(t=0)
Chaque fois qu'un noyau de potassium 40 se désintègre il
se forme un noyau d'argon 40 : à la date t, N0-NK
atomes de potassium 40 ont disparu ; il s'est formé NAr
=N0-NK atomes d'argon
40. D'où : N0 =NAr +NK.
loi de décroissance radioactive : NK(t)
= N0 e(-lt)
soit ln(NK(t) / N0 ) = l t.
t = -1/l
ln(NK(t) / N0 ) =-1/5,33
10-10 ln(2,36 1019 / 2,48
1019) = 9,47
107 ans.
|
|
chimie
organique (13 points)
Synthèse du benzoate d'éthyle à partir du
benzène :
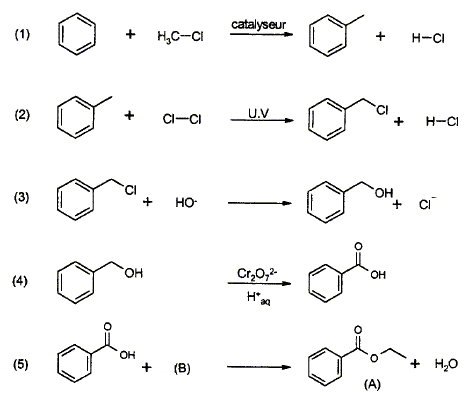
- Etape1 : de quel type de réaction s'agit-il ?
- Quel est le catalyseur usuellement utilisé ?
- Donner le mécanisme de la réaction.
- Etape 2 : quel est le rôle du rayonnement UV ?
- Etape 3 : de quel type de réaction s'agit-il ?
- Etape 4 : écrire les demi équations électroniques et
l'équation bilan de l'oxydation de l'alcool benzylique par le
dichromate de potassium K2Cr2O7
en milieu acide. On donne les couples : Cr2O72-
/ Cr3+ et Ph-COOH / Ph-CH2OH.
- Etape 5 : Donner le nom de la réaction mise en jeu
dans cette étape.
- Donner le nom et la formule semi-développée du réactif B.
- Le benzoate d'éthyle A ainsi synthétisé est soumis à
une mononitration par action de l'acide nitrique. De quel type de
réaction s'agit-il ?
- Justifier l'orientation induite par le groupement -COO-CH2-CH3
lors de la réaction.
- Représenter le composé majoritairement formé lors de cette
mononitration.
- Ecrire l'équation bilan de la réaction.
corrigé
étape
1 : substitution électrophile ( Friedel et Craft) sur le
noyau benzénique ; le catalyseur utilisé est un acide de Lewis AlCl3,
AlBr3.
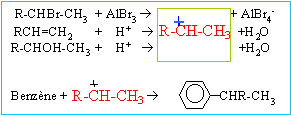
|
la formation du complexe s,
intermédiaire réactionnel est l'étape lente
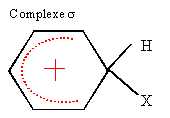
|
étape 2 : le rôle du rayonnement
UV est la formation de radicaux libres Cl.
en vue d'effectuer une substitution sur la chaîne latérale.
étape 3 : substitution nucléophile (
SN1 ou SN2) de l'atome de
chlore par le groupe -OH.
étape 4 :
2 fois{Cr2O72-
+14 H++6e- = 2Cr3+
+7H2O}
réduction de l'oxydant.
3 fois{ Ph-CH2OH
+ H2O = Ph-COOH +4 H++4e-
} oxydation du
réducteur
2 Cr2O72-
+3Ph-CH2OH + 16H+ =4Cr3+
+ 3 Ph-COOH +11H2O
étape 5 :
estérification; B est l'éthanol CH3-CH2-OH.
mononitration par action de l'acide
nitrique : substitution
électrophile ( nitration) sur le noyau benzénique.
le groupement -COO-CH2-CH3
, attracteur d'électrons, désactive ( diminue la densité électronique )
le noyau benzénique. Le sommet situé en "méta" est le moins désactivé.
composé majoritairement formé : 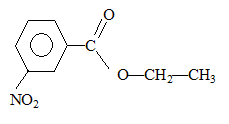
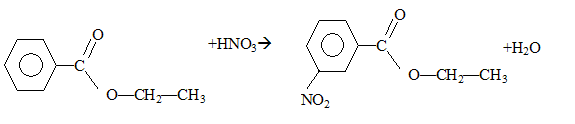
|
|
solution
tampon (12 points)
Le trihydroxyméthyl
aminométhane ((HO-CH2)3CNH2),
appelé TRIS, est souvent utilisé comme tampon. Sa zone de tampon
s'étend de 7,0 à 9,0. La constante d'acicité du couple mis en jeu (HO-CH2)3CNH3+/
(HO-CH2)3CNH2
est Ka= 8,7 10-9.
(HO-CH2)3CNH2
+ H2O = (HO-CH2)3CNH3+
+ HO-. (TRIS) + H2O =
(TRISH+) + HO-.
- Calculer la
constante de l'équilibre ci-dessus.
- Pour quel pH le
pouvoir tampon est-il maximal ?
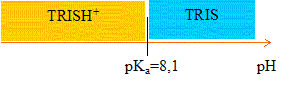
- Tracer le domaine
de prédominance des espèces TRIS et TRISH+ en
fonction du pH.
- Quel est le pH
d'une solution tampon contenant un volume V1 =
100 mL de TRIS à la concentration C1= 2,0 mol/L
et d'un volume V2= 200 mL de TRISH+
à la concentration C2= 1,2 mol/L.
- On ajoute un
volume v0 = 0,5 mL d'acide chlorhydrique à la
concentration C0=6,0 mol/L dans un volume V= 100
mL de cette solution tampon. Ecrire l'équation bilan de la réaction
prépondérante.
- Calculer les concentrations [TRIS] et [TRISH+]
présentes à l'état final.
- En déduire la valeur du pH de ce nouveau mélange et justifier le
caractère tampon de la solution initiale.
corrigé
TRISH+
+ H2O =TRIS + H3O+
; Ka = [TRIS][ H3O+]/[TRISH+
]
(1) TRIS + H3O+
= TRISH+ + H2O ;
constante d'équilibre 1/Ka
H3O+
+ HO- = 2H2O ; Ke
= 10-14 à 25°C
(2) 2H2O = H3O+
+ HO- , constante d'équilibre Ke
(1) +(2) donne : TRIS +H2O
=TRISH+ + HO- constante
d'équilibre Ke / Ka= 10-14
/ 8,7 10-9 = 1,15 10-6.
Le pouvoir tampon est
maximal à pH=pKa = -log 8,7 10-9
= 8,0,6 voisin 8,1.
pH= pKa
+ log ([TRIS]/[TRISH+]) avec : [TRIS] = C1V1/(V1+V2)
; [TRISH+] = C2V2/(V1+V2)
;
[TRIS]/[TRISH+]
= C1V1/(C2V2)
= 200/(1,2*200) = 1/1,2 =0,833 ; log 0,833 = -0,079
pH= 8,06-0,079 = 7,98.
ajout d'acide
chlorhydrique : TRIS + H3O+
= TRISH+ + H2O ; K= 1/Ka
= 1,15 108 donc réaction totale
Quantité de matière
(mol) : d'acide chlorhydrique ajouté : c0v0
= 6*5 10-4 = 3 10-3 mol
Dans 100mL de tampon
: n(TRIS) initiale : C1V1
*100/300 = 0,0667 mol ; n(TRISH+) initiale : C2V2*100/300
= 0,080 mol ;
3 10-3
mol de TRIS disparaît : ( il reste 0,0637 mol TRIS) et 3 10-3
mol de TRISH+ apparaît ( il y a finalement :
0,083 mol TRISH+)
[TRIS]/[TRISH+]
= 0,0637/0,083 = 0,768 ; log 0,768 = -0,115
pH= 7,98-0,115 = 7,86
variation relative de
pH : 100*0,115/7,9 = 1,3 %
Le pH varie très peu
lors de l'ajout modéré d'acide chlorhydrique : c'est une des propriétés
d'une solution tampon.
|
|
retour
-menu
|